
「中共肺炎」疫情正在快速蔓延,超過28個國家地區已證實確診病例。(圖片來源:Adobe stock)
【看中國2020年2月4日訊】2019新型冠狀病毒肺炎(2019-nCoV,又稱:中共肺炎)疫情正在快速蔓延,超過28個國家地區已證實確診病例。英國牛津大學材料科學系博士秦才東向《看中國》投稿發表自己發現的遏止「中共肺炎」疫情一種新方法:通過主動增加體液鹼性,中和冠狀病毒刺突S蛋白上正電荷,使病毒失去方向和動力,使病毒無法識別和附著於帶負電荷的細胞受體ACE2。
英國牛津大學材料科學系博士秦才東文章原文內容如下:
病毒感染過程中第一步是依靠靜電吸引與細胞受體發生粘附結合。冠狀病毒刺突蛋白攜帶正電荷,細胞受體ACE2帶負電荷,才是感染發生的物理基礎。中和刺突蛋白正電荷,應該是一種最經濟、可以最快速解決當前病毒傳染致病的方法。無需另外安排生產藥劑,無需配置特別專業人士,無需增加醫院病床。
註:ACE2攜帶負電荷可飽和,增加負離子濃度,不影響負電荷數,但可減少病毒所攜帶的正電荷數。
病毒感染的第一驅動力:陰、陽離子電荷之間的靜電引力
抑制病毒感染的廣譜方法:中和陽離子,屏蔽正電荷
病毒感染過程中的第一步是與細胞受體發生粘附結合,第二步才是特異性蛋白之間的選擇性作用。病毒結合細胞受體主要是通過病毒吸附蛋白(VAPs)依靠靜電吸附於細胞表面分子上。受體是病毒遇到的第一個細胞分子,若能對病毒的VAPs蛋白或受體進行屏蔽,病毒也就無法識別和附著宿主細胞表面,感染就不會實際發生。目前屏蔽VAPs蛋白和受體的方法,如李愛民、梁國棟所總結,是利用病毒受體模擬分子結合相應的病毒,以及利用病毒吸附蛋白VAPs模擬分子同受體結合,通過這種競爭性結合,阻斷病毒的感染【李愛民、梁國棟,「病毒受體研究進展」,中華實驗和臨床病毒學雜誌1997年第11卷第3期,299】。
趙清、李冬綜述,如果找到病毒粘附蛋白VAPs以及病毒受體,就可以兩面夾擊,從兩個方面阻斷病毒與受體結合,一是封閉病毒的受體結合位點,另一方面可封閉受體,都可以阻斷病毒與受體的結合,且環境的pH、離子對病毒吸附受體有影響【趙清、李冬,「病毒受體及其研究現狀」,動物醫學進展,2009,30(7):95-100】。
由於病毒沒有能量和物質的獨立製造系統,因此其與受體結合的唯一初始驅動力只是靜電吸引,但因為尚缺少可以主動調節人體體液酸鹼性的有效工具和手段,在病毒的預防和治療方面,目前的技術方法都還沒有涉及通過主動改變體液的酸鹼性,來改變受體或配體攜帶電荷數量,達到屏蔽或部分屏蔽受體或配體電荷的方法。
當細胞受體帶正電荷時,只能選擇性的接受配體帶負電荷的病毒,同理,當細胞受體帶負電荷時,只能選擇性的接受配體帶正電荷的病毒。可以合理預期的是,如果能夠主動調節病毒、細菌或細胞受體表面電荷性質和數量,那麼病毒、細菌和細胞之間是否可以結合或結合的機率也隨之可以調節。
病毒或細胞表面蛋白的電荷來源於氨基酸殘基上氨基和羧基的水解反應,其中氨基可攜帶正電荷,羧基可攜帶負電荷。該反應受溶液的pH值影響,因此如果能夠主動調節溶液(唾液、胃液或血液等體液)的pH值,就可以主動影響病毒、細胞表面電荷狀態,以及相互之間的靜電吸引力的大小。增加溶液的pH值,如果攜帶負電荷的氨基酸殘基上仍有未解離的羧基,則將繼續增加負電荷數,直至氨基酸殘基上所有的羧基全部解離;如果氨基酸殘基上的羧基已經全部解離或只有一個羧基,則增加pH值,不能再改變所攜帶負電荷的數量。增加pH值可以使攜帶正電荷的氨基酸殘基上氨基所攜帶的正電荷逐步減少,即氨基上結合的氫離子H+逐步減少,直至攜帶電荷數為0(等電點),其後如能繼續增加鹼性,則開始使氨基酸殘基上的羧基開始攜帶負電荷,負電荷的數量隨著pH值的增加而增加,直至全部羧基解離。
對於攜帶正電荷的病毒,如SARS、MERS以及當前的2019-nCoV病毒,增加pH值,病毒攜帶的正電荷數逐步減少;對應的攜帶負電荷的受體電荷數或不變或逐步增加,根據受體上羧基數量而定。其結果是,配體和受體之間的靜電吸引減弱直至消失。對配體或受體的實際屏蔽抑制效果依賴於pH值,依賴於劑量。
關於冠狀病毒:病毒攜帶正電荷,受體ACE2攜帶負電荷
冠狀病毒依靠刺突蛋白(S)與細胞結合達到入侵目的。SARS是用S蛋白與血管緊張素轉換酶2(ACE2)結合入侵,中東呼吸綜合症MERS則是S蛋白與二肽基肽酶4(DPP4)結合入侵。雖然SARS和2019-nCoV的S基因十分不同,但最後形成的S蛋白,折疊構型卻幾乎相同。2019-nCoV的S蛋白和ACE2進行模擬結合成功,可以推測2019-nCoV入侵細胞方法和SARS一樣經由ACE2,所以入侵用的蛋白才會一樣【Science China:Life Sciences,Letter to the Editor,在先發表,Xiantian Xu等,Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modelling of its spike protein for risk of human transmission,Jan.21,2020】。
SARS-CoV的S蛋白由含有1300aa的前體蛋白結合成,可以被宿主蛋白酶切割成氨基(N)末端S1亞基和羧基(C)末端S2亞基。其中,S1亞基含有受體結合域(RBD)結構域,可以與細胞表面的受體特異性結合,是決定細胞嗜性、宿主範圍和動物傳播的關鍵部分。而氨基末端(N)帶正電荷決定了只有受體帶負電荷的細胞才有被SARS-CoV感染的可能性。王新泉等研究報告表明,MERS-CoV的受體結合域RBD和受體DPP4通過分子表面形狀和電荷的互補性相互作用【Cell Research,期刊在線,SARS冠狀病毒刺突蛋白冷凍電鏡結構揭示其受體結合的必需構象狀態「,2016年12月23日】。後續研究表明,存在一個位於MERS-CoV刺突蛋白的N端結構域上的抗體中和表位【王新泉等,Nature Communications,」中東呼吸綜合症冠狀病毒刺突蛋白N端結構域上抗體中和表位的結構解析,2019年7月11日】。由此說明,MERS病毒刺突蛋白的表面是由可攜帶正電荷的N端氨基酸形成,對應的受體DPP4結合端類似如下所述的ACE2只能帶負電荷。
上述關於SARS和MERS的結論是,兩者的配體刺突蛋白向外的末端都是以帶正電荷的N端與細胞受體粘附結合。可以推測,如同2019-nCoV病毒與SARS病毒的刺突蛋白的折疊構型幾乎相同一樣,兩者的刺突蛋白都具有類似的末端帶正電荷的N端結構。
ACE2作為羧肽酶,其催化活性受pH值和離子強度的影響【Tipnis SR等,J.Biol Chem,2000,275:33238-33243】,其機制之一應該是pH值的變化影響了ACE2攜帶電荷數量的變化。人類ACE2酶模型顯示ACE2分子頂端的金屬肽酶區域分為兩個亞域,I和II,形成長而深的溝,深溝表面和周圍的隆起帶有很高的負電荷【Li W等,J.Nature,2003,426:450-454】。隆起線的負電荷與病毒的S蛋白配體的RBD的正電荷互補,使得病毒S蛋白與ACE2受體結合。
根據張玲的綜合研究報告,SARS病毒蛋白受體結合區域的第487位蘇氨酸是與人ACE2結合的關鍵位點,可與人ACE2上的第41位酪氨酸和第353位賴氨酸結合。因此推測,第41位酪氨酸(生理條件下帶負電荷)也是與S蛋白RBD(帶正電荷)結合的關鍵位點。按所述,第41位和第353位氨基酸與人一樣的各類蝙蝠都可以被SARS-CoV感染。而皮氏菊頭蝠可能主要是因為ACE2第41位氨基酸為組氨酸(生理條件下帶正電荷)而非(帶負電荷)的酪氨酸,從而不能通過皮氏菊頭蝠侵染靶細胞【張玲,「蝙蝠ACE2與SARS-CoV S蛋白相互作用的關鍵氨基酸鑒別」,2010年黑龍江大學碩士學位論文】。或許正說明,因為S蛋白的RBD正電荷與組氨酸的正電荷互相排斥而不能發生接觸和感染。由此也說明瞭,改變環境酸鹼性可以影響帶正電荷配體的冠狀病毒與帶負電荷受體的細胞的附著,從而達到對病毒感染的預防控制或治療效果。
可以預期,通過主動增加體液鹼性,也可以達到上述改變pH值或置換氨基酸改變酸鹼性的效果。即,中和了冠狀病毒刺突蛋白上的正電荷後,相當於使病毒失去了方向,失去了動力,病毒將無法識別和附著到帶負電荷的細胞受體ACE2上。當然,實際效果需要臨床驗證。
實測唾液中負離子濃度可以30秒內增加1萬倍,尿液中最高增加1000倍,血液中增加10倍,足以顯著地降低病毒蛋白刺突上正電荷的數量,預期可以1小時內發揮療效,且無毒無害無副作用,病人可以在家服用,減輕社會的醫療負荷。作為替代的試驗之一,經頸部皰疹病毒塗抹試驗,經常遷延復發的膿皰塗抹半小時後周邊紅色即開始消退,1天後膿皰開始結痂。
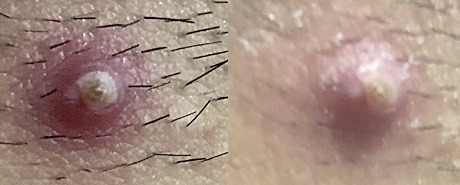
左圖是塗抹前,右圖是塗抹後半小時拍攝。(圖片來源:秦才東提供)
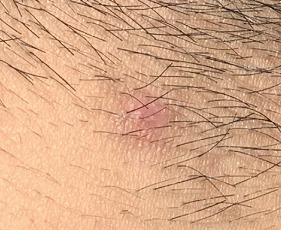
每天塗抹數次,上圖是第7天拍攝。(圖片來源:秦才東提供)
冠狀病毒依靠刺突尋找靶細胞,中和了病毒刺突上的正電荷後,相當於使病毒失去了方向,失去了動力,病毒將無法識別和附著到帶負電荷的細胞受體ACE2上。請見推特中的圖片。
How does #2019nCoV #Coronavirus spread? Most likely by the virus being carried on a droplet of liquid (as from a sneeze or cough) or on a dust mote. Both substrates are usually big enough to be filtered out by a n95 mask (best fit tested) & maybe by a surgical mask (NOT as good!) pic.twitter.com/DDIFL2KNra
— 🇺🇸 DeplorabLynn ❌ (@LynnMagoo) February 1, 2020
2019新型冠狀病毒(圖片來源:CDC/公有領域)
馬鞍山方程式環境科技有限公司
秦才東博士
2020年2月4日
来源:看中國來稿
短网址: 版權所有,任何形式轉載需本站授權許可。 嚴禁建立鏡像網站。
【誠徵榮譽會員】溪流能夠匯成大海,小善可以成就大愛。我們向全球華人誠意徵集萬名榮譽會員:每位榮譽會員每年只需支付一份訂閱費用,成為《看中國》網站的榮譽會員,就可以助力我們突破審查與封鎖,向至少10000位中國大陸同胞奉上獨立真實的關鍵資訊, 在危難時刻向他們發出預警,救他們於大瘟疫與其它社會危難之中。








