
《我不是药神》预告视频截图
【看中国2018年7月6日讯】近期热映的电影《我不是药神》,很可能是今年最有价值的中国影片。剧情改编自真实事件:徐峥饰演的保健品店主在一群癌症患者的恳求下,成了某种印度产“救命药”的总代理商,由此卷入生活和法律的漩涡中。
“救命药”需要代购,已经成了中国重病患者无奈的选择。从印度、土耳其、孟加拉、以色列购买的仿制药,正源源不断流入中国。
同一种药品,国内“正版”原研药的价格,常常是印度仿制药价格的十倍以上。新闻报道称,一家印度代购商月流水可以达到700万元人民币。
仿制药,为什么印度行,中国不行?很多人将此归咎于专利法和加入WTO导致的医药专利壁垒。
但事实上,这并非主要原因。真正的问题在于,在中国开发仿制药,从头到尾都举步维艰。
仿制药,专利壁垒不是事
专利壁垒的确广泛存在于制药行业。比如《我不是药神》中化名“格列宁”的格列卫,是白血病人们的救命药,自诞生之日起就自带专利。
格列卫(网络图片)
格列卫是一种直接推动了人类进步的药物。它可能是人类历史上第一种真正的“靶向药物”。
从发现靶点到2001年获批上市,格列卫的“出生”整整耗费了五十年,制药企业诺华投资超过50亿美元,直接成就了5位美国科学院院士,还催生了两项足以获得诺奖的重大发现。
格列卫这样的研发周期和投入,如果没有专利,估计就再也没有企业愿意生产了。所以,它的价格也非常惊人。
2015年,瑞士产的原版格列卫,100mg*60片一盒定价23500元,根据不同的适应症,够用两周至两个月不等。在中国,由于独特的关税、定价和销售制度,它的价格更加惊人。即便是在邻国印度,原厂格列卫的价格也在一万人民币左右。
不过对印度人而言,原版药价格高昂并不十分要紧,因为印度实行了一套独特的制度来保证仿制药的生产,使得印度成为世界公认的仿制药第一大国。仿制药不是“假药”,它是“仿制”其他专利药进行研发和生产的正规药物。
印度低药价不仅造福本国人民,也造福了难以负担高药价的外国人,印度仿制药出口已逐步产业化。
一提到“为什么中国仿制药不行”,很多分析就将专利壁垒当作问题的关键,搬出印度曾经长期对外国药品专利的不支持,以及对国际“药品专利强制许可”的执行力度。
所谓“药品专利强制许可”,简单来讲,就是当重大公共健康危机发生——比如说传染病、发病率高的重大疾病,而该国又没有能力生产“救命药”时,就可以通过一系列法律框架和谈判,强行取得专利。
但很少有人注意到的是,印度为仿制药提供的法律制度性支持,中国法律制度并非没有提供。
和印度一样,中国也经历过长期没有专利相关法律法规的年代,以及有专利法但几乎没有执行的年代。1985年第一版专利法根本没有保护药品。直到1992年,为了入世谈判,中国出台了一系列过渡性法规。2001年加入世贸组织后,中国才有了规范的药品专利法规。
“强制许可”也有法规支持。早在2006年1月,中国就通过了《涉及公共健康问题的专利实施强制许可办法》。2015年,卫计委又出台了《关于印发中国癌症防治三年行动计划(2015-2017年)的通知》,其中提到:

按理说,中国可以拥有跟印度一样强大的“药品专利强制许可”谈判能力。不过,由于各方利益难以平衡,这项规定在中国《专利法》颁布30年以来,一次都没有被实践过。
连在2005年禽流感肆虐的时期,中国也没有批准广州白云山对“救命药”达菲的强制许可请求,而是通过谈判,让罗氏把达菲的生产授权给了其他两家企业。
事实上,在专利制度方面,中国的专利法和宽松的专利管理已经尽力了。就在今年,国务院还出台了“20号意见”,放宽了专利限制,鼓励强制许可。
想要做仿制药,专利甚至可以完全不是问题——最近的十年刚好是仿制药的黄金时间,因为“专利断崖”来了。
药品专利的保护也有一定期限,一般是6年。2013-2020年,全球每年专利到期品种平均超过200个,其中不乏明星品种。2014年,全球有326个原研药的专利到期,都可以合法仿制。
因此,中国难以造出廉价的仿制药给患者使用,并不能怪到专利制度头上。虽然中国化学药品批号95%以上都给了仿制药,但从品类、疗效到价格,中国的仿制药都奇怪地毫无优势可言。
层层掣肘的中国仿制药行业
在中国做新药难,做仿制药也难。做药难,首先就难在药企能力的不足。
为了说明这一点,首先要从制药的生产流程说起。
制药非一日之功,化工原料要经过一系列复杂的处理,这个过程中的产物叫医药中间体。最终得到的有效成分,称为原料药,也就是药品中的有效成分。有了有效成分,我们还要把它提纯,加入药品辅料,做成真正的胶囊、药片、注射剂。这是需要一整个产业链才能完成的事。

如果你要做一种仿制药,除了把“正版”研究透,还要寻找合适的中间体、原料药,以及药品辅料了。而这些东西,大多数是由全国四千余家中小型药企生产的。
中国大多数原料药和制剂药企都是中小企业,“百强”的市场集中度大概只有50%左右,远低于全球范围内的80%左右。其中,很多企业连《药品生产质量管理规范》(GMP质量标准)和环保排污的要求都达不到。
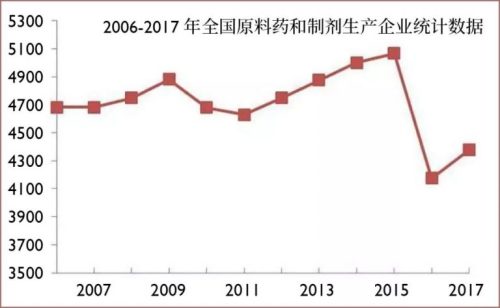
中国原料药和制剂药企数量统计。2016年GMP质量体系“实装上线”、环保严查运动之后,这些企业的数量一下锐减将近一千家。
企业规模上不去,获得融资能力和研发能力也上不去。至今中国生产和出口量最大的原料药,还是低端老四样:维生素,食品添加剂、甜味剂,抗生素。这些“大路货”占据产能,同时带来原料药生产利润低下、高端品种依赖进口的问题,形成恶性循环。
药品辅料的问题更是一言难尽。
相比于美国FDA要求仿制药的辅料达到和药品相同的标准,中国的药品辅料生产和使用基本上没有规范。虽然早在2006年中国就出台过《药用辅料生产质量管理规范》(药辅GMP标准),但这个标准是非强制的,疏于管理、无人监督。

药品辅料,就是淀粉、膜衣、崩解剂、黏合剂、胶囊壳等等,帮助你更好地咽药和发挥药物作用的成分。
别小瞧药品辅料的作用。一颗好的胶囊能够决定一粒药是在口腔、胃里还是肠道里准确地散开,进而直接影响仿制药的药效。一颗糟糕的胶囊则可能来自铬超标的工业明胶。

2014年中国发生毒胶囊事件,约9000万粒有害胶囊流入市场。
当原料齐备,你的仿制药终于可以研发制造了。这时候你需要解决的核心难题就来了:怎么确定仿制药和原来的药物效果一样?
仿制药可不是“假药”,做仿制药和开发新药一样,都需要规范的研发、生产、审评。光把药品的“物质”照样造出来还不够,还需要保证“一致性”——药理上一样,对人体的作用也一样。
然而,就在几年前,中国仿制药的一致性评价标准还是一片混乱。
比如,要审评“一致性”,首先得确定用来参照的原版药物是什么,专业名词叫“参比制剂”。要仿制阿莫西林,就得从全世界那么多品牌的阿莫西林里选择一种,才能有标准。
中国报备参比制剂的正式制度长期缺席。即便报备了,也有可能不能获得原研药企业的支持,甚至因为原版药退市完全买不到药。国内还出现过某品种的参比制剂公布太晚,导致43家企业集体“抄错对象”的惨案。

文件出来后,43家企业发现自己集体跑错了路。
因为审评制度和标准上的缺失,长期以来,国产仿制药安全而低效,参比制剂混乱、晶形和剂型随便、辅料业余、疗效无把关,除了肯定含有宣称的成分,其他一切都是不确定的。
2008年后,中国多次抽查了当时市面上合格的国产仿制药,与原研药进行“体外溶出曲线”的对比,发现几乎所有的国产仿制药都和原研药相去甚远。
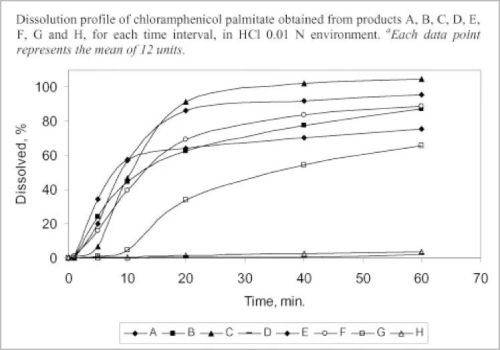
体外溶出曲线研究,可以在体外模拟人体对药物的溶解吸收情况。如果仿制药和原研药的溶出曲线差异太大,则疗效非常可疑。
好在,2013年,中国终于出台了仿制药一致性评价制度。溶出曲线已经纳入了评价“药学一致性”的重要指标。虽然技术标准极不完整,但总归是一大进步。
但别以为这就完了,因为后面还有更棘手的“生物等效性”的检验难题。
要审评仿制药的“生物等效性”,就很可能需要通过临床试验这一大难关。
由于相关规定,中国的临床实验只能在获得批准的、数量有限、排期紧缺的“临床试验基地”进行。这些基地大多同时又是三甲医院,仿制药难以搞出科研成果,这些基地的冷淡态度也就可想而知。
而最难的还在后面:
2006年国家药监总局局长郑筱萸因巨额受贿被执行死刑后的十年里,中国的医药审批一直谨慎行事,压量、拖期、能不批就不批。结果十年后,忽然到来的医药风口让中国的监管部门措手不及。

郑筱萸巨贪数百万,批准多种“假药”上市。沈阳一家杀鼠灭虫剂厂商将其姓名注册成了品牌,表示对贪官的痛恨。
2015年,中国负责药品审评的官员一共只有一百多人,需要面对一万多件新药、仿制药、医疗器械和进口药物的临床和上市申请,以及数千件补充申请和备案。
监管者的解决办法是:想方设法把你们打回去。
于是就有了2015年“731公告”中著名的积压与拖延条款,以专利期届满时间设卡,将很多已经排到了审评门口的仿制药直接赶回家:

好消息是,在不断的降积压手段之后,我们药品注册申请的积压项目,终于从2015年高峰时的近22000件,降到了2016年底的8863件,并在之后的一年中继续下降。
好了,费尽千辛万苦,你的仿制药终于通过了审评。
据估算,一个仿制药要在中国走通这个正规流程,至少需要500万到1000万人民币——这还不算各级寻租、积压拖延的成本。
由于做药难,中国的仿制药整体上并不便宜。
比如易瑞沙(吉非替尼,Iressa),由阿斯利康研发,是用于非小细胞肺癌的靶向药物。2016年国家药品价格谈判之后,原版250mg*10片/10天量的零售价是2358元。
易瑞沙在中国的专利已经在2016年4月到期,随后大批国资企业开始仿制。2017年2月,齐鲁药业的首仿品种“伊瑞可”获批上市,10天量的价格是1850元。
如果去代购印度版的仿制易瑞沙,10天量约合211元。当然,它在中国算“假药”。
用上救命药,依然不容易
如前所述,救命药即便在中国成功仿制,也很难人人买得起,一时半会指望不上。不过,中国人还有一根救命稻草:国家药品价格谈判,即由政府出面,向原产药企压低售价。
截至去年,累计谈判成功药物共有39种,基本上降价幅度都在“打五折”以上。
以最成功的替诺福韦(Viread)为例。这是一种由吉利德开发的乙肝一线用药,进入中国时的价格是1500元300mg*30片(一月量)。2016年,替诺福韦的专利有效性被几家中国企业起诉。经过几轮复杂的拉锯,法院判决替诺福韦所有专利无效,大批国产仿制药挤进战场。
同年,替诺福韦参与了国家价格谈判,直接降价67%,变成499元一个月,仅略高于印度版本。
不过,国家药品价格谈判的滞后性,使印度仿制药依然具有强大竞争力——现在,国内的患者已经开始从印度、老挝和孟加拉代购副作用更小的“替诺福韦二代”TAF了,代购价大概只有400元一个月。
而且,即便原版药品在国家谈判后降价了,或者有厂家真的生产出了良心价的国产仿制药,你也不一定能用得上。
这是因为,虽然中国的医保药品目录是通用的,由卫生部门确定,但医院采购、使用管理和核算报销政策是分省的,并且涉及到当地人社部门。多数一般药品只能靠药企反复公关,一个省一个省地拿下,或者拿不下。
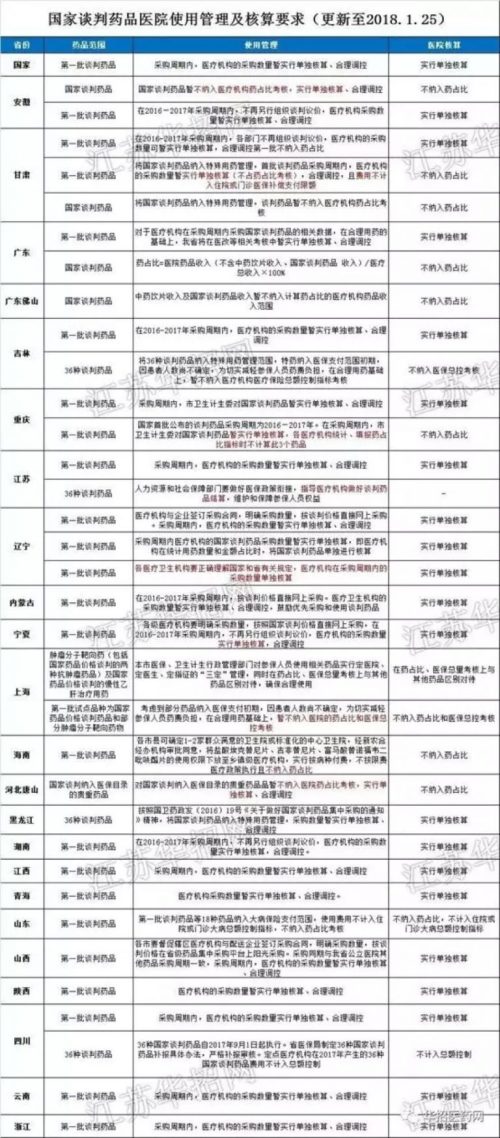
行业网站“华招医药网”总结的各省对国家谈判药品的态度。
而且,国家医保药品目录平均五年才更新一次。
虽然形势在逐渐好转,但在未来的几年中,国产平价救命药仍将是可望不可及。中国患者代购印度“假药”的困局,仍将持续下去。
不要忘了,依据检方的不起诉决定书,“药神”的原型陆勇之所以被法律宽恕,首要因素是因为其替病友代购的行为全部是无偿帮助,未收取任何额外费用,因此未被认定为销售行为。

陆勇,《我不是药神》主人公的原型,因帮助自己和其他患者代购印度仿制药,成为新闻人物。
如果病友信赖的代购者不再是陆勇这样完全无偿的完美被告人,所购药品依然被中国法律定义为“假药”,那么代购者仍必然构成刑法上的销售假药罪而身陷囹圄。
这是一部电影难以解决的问题。
